(1)67.5%(1分) (2)50g (1分) (3)约15.15%(2分)
分析:由图示可知生成氢气的质量为0.2g,根据氢气算出锌的质量,再用样品的质量减去锌的质量算出铜的质量,再计算质量分数.设要生成0.2g氢气需要锌的质量为X则:Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑65 2X 0.2g根据:
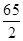
=
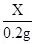
解得X=6.5g,铜质量为:20g-6.5g=13.5g,所以样品中铜的质量分数:
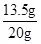
×100%=67.5%.(2)
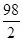
=
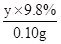
,y=50g(3)
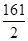
=
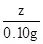
,z=8.05g所得溶液的溶质质量分数为:
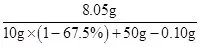
×100%≈15.1%答:(1)样品中铜的质量分数为67.5%;(2)消耗硫酸溶液的质量为50g;(3)所得溶液的溶质质量分数为15.1%.故答案为:67.5% 50g 约15.15%点评:本题主要考查有关化学方程式的计算和质量分数的计算,难度较大.计算所得溶液质量时,要注意:①不能把铜的质量计算在所得溶液中;②不能把生成氢气的质量计算在所得溶液中